A. Výklad a ukázkové příklady
Název oxidu se skládá z podstatného jména oxid a přídavného jména se zakončením podle oxidačního čísla.
Oxidy mají obecný vzorec MrOs, kde r je 1,2 a s 1 až 5 a 7.
Oxidy jsou binární sloučeniny kyslíku, obsahující O-II.
Přehled názvů a vzorců oxidů udává tabulka:
| Ox.číslo |
Koncovka |
Obec.vzorec |
Příklad |
| vzorec |
oxid |
| I |
-ný |
M2O |
K2O |
draselný |
| II |
-natý |
MO |
CaO |
vápenatý |
| III |
-itý |
M2O3 |
Fe2O3 |
železitý |
| IV |
-ičitý |
MO2 |
SiO2 |
křemičitý |
| V |
-ečný (-ičný) |
M2O5 |
P2O5 |
fosforečný |
| VI |
-ový |
MO3 |
SO3 |
sírový |
| VII |
-istý |
M2O7 |
Cl2O7 |
chloristý |
| VIII |
-ičelý |
MO4 |
OsO4 |
osmičelý |
Nutné je pouze zapamatovat si koncovky odpovídající ox.číslům. Vzorec i název si potom snadno odvodíme.
Ukážeme si to na příkladech:
|
(9)
|
|
|
|
Příklad1: Jaký má vzorec oxid chlorový?.
| = |
Kyslík má v oxidech vždy oxidační číslo -II. Napíšeme tedy O-II
Chlor má podle koncovky -ový ox.číslo +VI. Doplníme chlor ClVIO-II
Součet oxidačních čísel prvků ve sloučenině musí být nula (pravidlo 2).
K určení počtu atomů chloru a kyslíku nám pomůže tzv. křížové pravidlo:
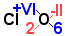
Potom skutečně pro oxidační čísla platí: VI.2 + (-II).6 = 12 - 12 = 0
Dostáváme tedy vzorec Cl2O6. Poměr počtu atomů 2 : 6 lze ješte zkrátit dvěma na poměr 1 : 3
a výsledný vzorec oxidu chlorového je ClO3.
K určení oxidačních čísel ze vzorce dáváme přednost rovnici (viz další příklad), protože
ze vzorce ClO3 by křížové pravidlo dávalo ox.číslo chloru III, ale ve skutečnosti je VI.
Výsledek: Oxid chlorový má vzorec ClO3
|
Příklad2: Určete název sloučeniny Cl2O5
| = |
Jde o sloučeninu chloru a kyslíku, tedy oxid chlor ... a koncovku přidáme podle ox.čísla chloru.
Kyslík má oxidační číslo -II a ox.číslo chloru označíme x: Clx2O-II5
Pro ox.číslo x platí: x.2 + (-II).5 = 0
Odsud dostáváme x = 5. Chlor má tedy ox. číslo V a název bude mít koncovku -ečný (chloričný česky nejde).
Výsledek: Cl2O5 se nazývá oxid chlorečný
|
|
Názvy polymerních oxidů se tvoří pomocí číslovkových předpon, udávajících počty jednotlivých atomů
v molekule oxidu.
|
(10)
|
|
Příklad3: Určete název sloučeniny P4O6
| = |
Jedná se o oxid fosforu. Obsahuje 6 atomů O (hexa) a 4 atomy fosforu (tetra), proto jeho název
začíná hexaoxid tetrafosfor ... a koncovku přidáme podle ox.čísla fosforu.
Kyslík má oxidační číslo -II a ox.číslo fosforu označíme x: Px4O-II6
Pro ox.číslo x platí: x.4 + (-II).6 = 0
Odsud dostáváme x = 3. Fosfor má tedy ox. číslo III a název bude mít koncovku -itý
Výsledek: P4O6 se nazývá hexaoxid tetrafosforitý
|
B. Příklady s krokovou kontrolou e-učitele
C. Příklady na procvičení učiva
Na následujících příkladech s výsledky se můžete zdokonalit ve znalostech učiva této lekce.
Pokud si nevíte s příkladem rady, užijte stručné nápovědy - Help.
| Příklady označené | A mají největší obtížnost, | B střední a | C nejmenší. |
D.Kontrolní test
E.Náhodný test
F. Hodnocení výsledků a komunikace s učitelem (tutorem)
Vytisknout certifikat
Hodnocení výsledků:
Komunikace s učitelem (tutorem):
Tato část je určena pouze pro registrované uživatele. Zaregistrujte se!
|